颂通:科学家利用干细胞首次开发出“人工小鼠胚胎”
- 创建时间:2017-03-06 点击数:
- 来自剑桥大学的科学家利用两种类型的干细胞以及3D支架,成功在培养基中制造出了一种类似小鼠胚胎的结构,相关研究刊登于国际杂志Science上。
内容
科学家利用干细胞首次开发出“人工小鼠胚胎”
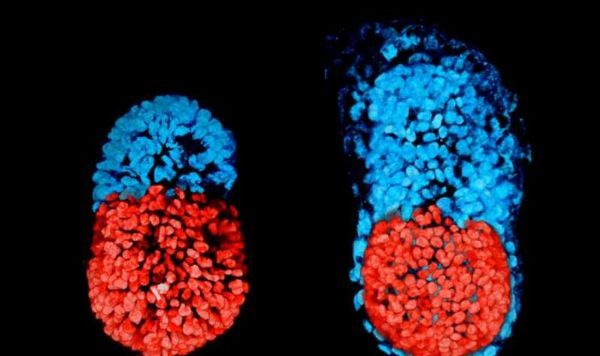
近日,来自剑桥大学的科学家利用两种类型的干细胞以及3D支架,成功在培养基中制造出了一种类似小鼠胚胎的结构,相关研究刊登于国际杂志Science上。理解胚胎发育的早期阶段一直是科学家们非常感兴趣的领域,因为其能够帮助解释为何有超过三分之二的人类妊娠会发生失败。
一旦哺乳动物的卵细胞同精子结合受精,其就会进行多次分裂产生一种小型的漂浮状态的干细胞,这种特殊的干细胞最终就会制造出人类完整的机体结构;胚胎内部的胚胎干细胞(ESCs)簇会向胚泡的阶段发展,胚泡中的其它两类名为胚外滋养层干细胞(TSCs)则会形成未来的胎盘结构,原始内胚层的干细胞会形成所谓的卵黄囊,从而确保胎儿的器官能够正常发育,并且为胎儿发育提供营养。
此前研究人员仅利用胚胎干细胞来尝试制造出胚胎样结构只取得了有限的成功,这是因为早期的胚胎发育需要不同类型的细胞之间互相协调完成;然而在本文研究中,研究人员利用遗传修饰化的小鼠ESCs和TSCs,结合名为细胞外基质的3D结构支架,开发出了一种能够进行自我组装的结构,同时这种结构的发育以及架构非常类似于自然胚胎的状态。研究者Magdalena Zernicka-Goetz教授说道,胚胎和胚外细胞会开始彼此交流,并且组装成为和胚胎非常相似的结构,在研究中我们发现两种类型的干细胞之间存在明显的交流,从某种意义上来讲,这些细胞能够告诉彼此胚胎能够开始发育的地方。
不同类型的干细胞之间的相互作用对于胚胎发育非常重要,但需要指出的是,本文研究中研究者发现两类干细胞(ESCs和TSCs)可以真正地互相引导,如果没有这种伙伴关系,胚胎形状的正确发育、形成以及关键生物学机制的活性或许就不会适当地发生。将这种“人工胚胎”比喻为一种正常发育的胚胎结构,研究者就能够发现这种“人工胚胎”的发育遵循着正常的模式来进行自我组装。
研究者表示,当这种人工胚胎同真实的事物非常相似时,其或许并不能够进一步发育成为健康的胎儿,如果想要继续发育的话,其或许就需要第三种形式的干细胞,即能够提供卵黄囊发育的干细胞。Zernicka-Goetz说道,他们所开发的技术能够促进胚泡在体外植入阶段进行发育,从而就能够帮助研究人员首次对受精后13天的人类胚胎发育的关键阶段进行分析,而且这种最新的发育阶段能够帮助克服人类胚胎研究的主要屏障,即胚胎的短缺,当前研究人员主要是通过人工受精门诊所提供的卵细胞受精后的胚胎进行研究。
研究者表示,利用这种新型技术,对人类胚胎和胚外干细胞进行研究或许就能够在模拟胚胎发育的关键事件,而这或许也能够帮助他们在不对胚胎进行研究的情况下来研究胚胎发育关键阶段的重要事件。理解胚胎正常发育的过程对于阐明为何胚胎发育失败或许具有一定的指导意义。
最后研究者Andrew Chisholm表示,我们在培养基中首次开发出了人工小鼠胚胎,这对于我们研究哺乳动物发育的最早期阶段或许提供了一定的研究材料,进行基础性研究对于我们解决很多研究难题,阐明人类发育的关键过程,以及理解婴儿在母体环境中发生缺陷甚至死亡的原因非常重要。
更多C+CELL细胞处理工作站相关行业的资讯请登录:http://www.chance-bio.com/
Assembly of embryonic and extra-embryonic stem cells to mimic embryogenesis in vitro
Abstract
Mammalian embryogenesis requires intricate interactions between embryonic and extra-embryonic tissues to orchestrate and coordinate morphogenesis with changes in developmental potential. Here, we combine mouse embryonic stem cells (ESCs) and extra-embryonic trophoblast stem cells (TSCs) in a 3D-scaffold to generate structures whose morphogenesis is remarkably similar to natural embryos. By using genetically-modified stem cells and specific inhibitors, we show embryogenesis of ESC- and TSC-derived embryos, ETS-embryos, depends on crosstalk involving Nodal signaling. When ETS-embryos develop, they spontaneously initiate expression of mesoderm and primordial germ cell markers asymmetrically on the embryonic and extra-embryonic border, in response to Wnt and BMP signaling. Our study demonstrates the ability of distinct stem cell types to self-assemble in vitro to generate embryos whose morphogenesis, architecture, and constituent cell-types resemble natural embryos.

 会员登录
会员登录


